Vous êtes ici : Cinétique chimique >2000 : Corrigé Saponification d'un ester
1.Expression de la concentration de l'acool
| + | + | |||||||
| à |
||||||||
| à |
|
|||||||
| à |
2.
3. La vitesse est maximale à l'instant car la concentration des réactifs est maximale à cette date
4. Le temps de demi réaction est le temps au bout duquel la moitié de l'alcool s'est form à c.à.d s'est formé. Ceci correspond à
minutes
5. Vitesse moyenne entre les instants 9 et 15mn :.
6. Le volume X à 50°C doit être inférieur au volume X à 30°C, car la température étant un facteur cinétique, à 50°C il restera moins de base, donc il faudra moins d'acide.
Vous êtes ici : Cinétique chimique >Corrigé 2001 : hydrolyse d'un ester
1.
Formule semi-développé}e du 2-méthylbutanoate de méthyle.
La molécule est chirale car elle contient un carbone asymétrique
Représentation spatiale


2.
équation d'hydrolyse
A est le méthanol
B est l'acide 2-méthylbutanoîque
3.
3.a)
nombre de mole d'ester restant : le nombre initial de mole d'ester
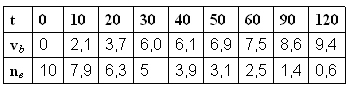
Les valeurs de ne sont multipliées par
3.b) temps de demi réaction est le temps au bout duquel la moitié de l'ester a réagi.
3.c) vitesse de réaction
Vous êtes ici : Cinétique chimique >Corrigé 2006 cinétique de la réaction entre l’acide éthanedioïque et les ions permanganate
:
et
et
2.1:
La solution résulte d’une dilution de la solution initiale d’acide oxalique donc la quantité de matière d’acide oxalique de la solution initiale ; est égale à la quantité de matière d’acide oxalique de la solution S ;
soit :
2.2 : La quantité de matière d’ions permanganate contenue dans un volume de 1 mL de la solution de permanganate de potassium :
\times
2.3 :
est la quantité de matière d’ions permanganate qu’il faut utiliser pour oxyder entièrement la quantité de matière
d’acide oxalique initial.
La relation de proportionnalité donne :
Aussi et
est le volume maximal de la solution de permanganate de potassium qu’il faut utiliser pour oxyder entièrement l’acide oxalique présent dans la solution S.
D’où
Le nombre maximal de prélèvements de la solution de permanganate de potassium à effectuer est : prélèvements
2.4 :
| n(Mn2+) en 10-5 mol | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| t(s) | 0 | 110 | 150 | 172 | 188 | 202 | 220 | 268 |
2.4.1 :
Explication des calculs qui ont permis de dresser le tableau à partir des mesures effectuées.
En partant de l’équation bilan de la réaction :
on constate qu’à chaque date t, la quantité de matière de est égale à celle de
donc :
à la date on a
à la date on a
à la date on a
est donc une suite arithmétique dont le premier terme est 0 et la raison
.
A la date on a
Exemple :
À la date on a
.
2.4.2 : Courbe représentant la variation du nombre de moles d’ions formé en fonction du temps.
2.4.3 :
la vitesse instantanée de formation des ions Mn^{2+} est donnée par la relation :
2.4.4 :
La vitesse augmente de la date t = 0 à la date t = 200 s ensuite elle diminue jusqu’à la fin de la réaction.
Cette augmentation de la vitesse est due à la présence des ions qui « autocatalysent » la réaction.
Vous êtes ici : Cinétique chimique >Corrigé 2005 : réaction entre les ions péroxodisulfate et les ions iodure
Péroxodisulfate de potassium :
iodure de potassium :
2.1: Calcul des quantités de matière initiales des réactifs.
Quantité de matière de péroxodisulfate de potassium :
Quantité de matière d'iodure de potassium :
Montrons que l'ion iodure est le réactif limitant.
D'après les coefficients stoechiométriques de l'équation bilan de la réaction :
1 mol d'ions péroxodisulfate réagit avec 2 mol d'ions iodure donc il faudrait d'ions iodure pour faire disparaître tous les ions péroxodisulfate.
Or nous disposons de 0, 015 mol d'ions iodure qui est inférieur à 0,02 mol donc l'ion iodure est le réactif limitant.
2.2 : concentration finale en diiode.
A la fin de la réaction, la quantité de matière de diiode est égale à la moitié de la quantité de matière initiale d'ion iodure :
2.3:
modélisation de la concentration molaire instantanée en diiode : .
A l'état final t donc
.
est donc égal à la concentration finale de
soit
.
2.4.1:
La vitesse volumique instantanée de formation du diiode est donnée par l'expression :
2.4.2:
L'expression de la vitesse volumique instantanée de formation du diiode à t = 0 est :.
2.4.3:
2.4.4:
Détermination graphique de la vitesse volumique instantanée de formation du diiode :
- à t = 0
- à t = 10 min
Détermination de la valeur numérique de k.
Application numérique :
Détermination de l'unité de k.
En partant de l'expression ,
et
ont la même unité :
donc est sans unité, de même que
.
L'unité de k est .
Vous êtes ici : Cinétique chimique >Corrigé 2003 : Décomposition du chlorure de benzène diazonium
V = 35 mL ; ; t = 17° C ; P = 1 atm
1.1 :
Concentration initiale de chlorure de benzène diazonium : avec
et
est le nombre de mole initiale de chlorure de benzène diazonium
est la masse initiale de chlorure de benzène diazonium
est la masse molaire moléculaire de chlorure de benzène diazonium
Soit =
Apllication numérique : =
1.2 :
inserer image
n est le nombre de mole de qui a réagi à la date t
soit =
n est aussi le nombre de mole de formé à la date t :
soit =
est le volume molaire d'un gaz à la température t et à la pression P
=
donc
soit
donc =
1.3.1 :
le temps de demi - réaction t est la date à laquelle la moitié du nombre de mole initial de a réagi. A cette date, il reste
mol de
qui n'a pas réagi soit :
=

En utilisant le graphe, on trouve t = 465 s.
1.3.2 :
A la date t on a :=
1.3.3 :
La vitesse instantanée de disparition du chlorure de benzène diazonium est = -
1.3.4 :
La variation de vitesse entre et
est expliquée par la diminution du nombre de mole de réactif au cours du temps.
1.4 :
A la fin de la réaction, on obtient de
soit :
=
EXAMEN.SN V2.0 © RESAFAD SENEGAL  - Avenue Bourguiba x rue 14 Castors, Dakar (Sénégal) - Tél/Fax : +221 33864 62 33
- Avenue Bourguiba x rue 14 Castors, Dakar (Sénégal) - Tél/Fax : +221 33864 62 33