Vous êtes ici : Cinétique chimique >Corrigé 2001 : hydrolyse d'un ester
1.
Formule semi-développé}e du 2-méthylbutanoate de méthyle.
La molécule est chirale car elle contient un carbone asymétrique
Représentation spatiale


2.
équation d'hydrolyse
A est le méthanol
B est l'acide 2-méthylbutanoîque
3.
3.a)
nombre de mole d'ester restant : le nombre initial de mole d'ester
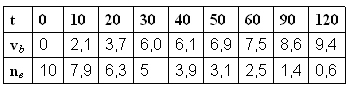
Les valeurs de ne sont multipliées par
3.b) temps de demi réaction est le temps au bout duquel la moitié de l'ester a réagi.
3.c) vitesse de réaction
EXAMEN.SN V2.0 © RESAFAD SENEGAL  - Avenue Bourguiba x rue 14 Castors, Dakar (Sénégal) - Tél/Fax : +221 33864 62 33
- Avenue Bourguiba x rue 14 Castors, Dakar (Sénégal) - Tél/Fax : +221 33864 62 33