Vous êtes ici : cinétique chimique >Corrigé 2009 : Etude cinétique de la réaction d’hydrolyse de l’éthanoate d’éthyle
1. :
La réaction est lente, limitée (par la réaction inverse) et athermique.
2.
On place les tubes dans la glace avant chaque dosage pour bloquer la réaction.
3.
La quantité de matière d’ester présent dans chaque tube à la date t = 0.
4.
Le nombre de mol n’ d’acide formé dans un tube, à la date t, est égal au nombre de mol d’ester disparu ; d’où le nombre de mol d’ester restant est donné par :
A l’équivalence de la réaction de dosage on a :
La quantité de matière d’ester restant à la date t est donnée par l’expression :
Ce qui permet de compléter le tableau ; soit :
| t(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 90 | 120 |
| 0,0 | 2,1 | 3,7 | 5,0 | 6,1 | 6,9 | 7,5 | 8,6 | 9,4 | |
| 5 | 3,95 | 3,15 | 2,50 | 1,95 | 1,55 | 1,25 | 0,70 | 0,30 |
5.
La courbe est représentée ci-après :
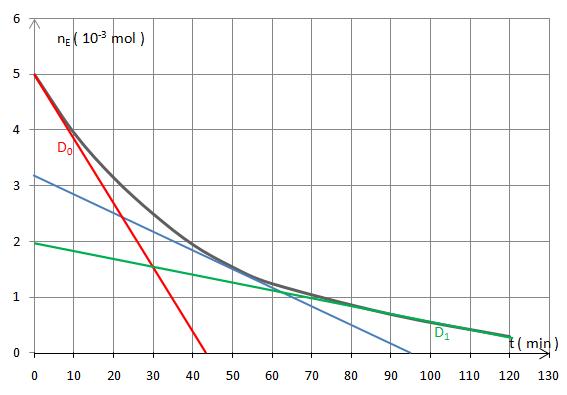
6.
La vitesse est donnée par l’opposée de la pente de la tangente à la courbe en chaque point.
A partir de la courbe, on constate que l’opposée de la pente de la tangente à la courbe diminue au cours du temps. Comparer par exemple, sur le graphe, la pente de (tangente à t = 0) et celle de D (tangente à t = 120 min).
Donc la vitesse diminue au cours du temps.
7.
Pour augmenter la vitesse de cette réaction, on peut :
- Augmenter la température du milieu réactionnel.
- Utiliser un catalyseur
Vous êtes ici : chimie oganique > 2004 : Synthèse de l'aspirine
EXAMEN.SN V2.0 © RESAFAD SENEGAL  - Avenue Bourguiba x rue 14 Castors, Dakar (Sénégal) - Tél/Fax : +221 33864 62 33
- Avenue Bourguiba x rue 14 Castors, Dakar (Sénégal) - Tél/Fax : +221 33864 62 33